取引
EBCについて
公開日: 2026-02-11
MRNA株は時間外取引で下落しています。これは、FDA(米国食品医薬品局)が投資家がモデルナのCOVIDフランチャイズ以降の最も現実的な「次の製品」への橋渡しの一つと見なしていたプログラムに対して明確な停止を示したためです。
FDAの生物製剤評価研究センター(CBER)は、モデルナが提出した季節性インフルエンザワクチン候補、mRNA-1010 の生物学的製剤承認申請(BLA)について、受理拒否(Refusal-to-File: RTF)レターを発出しました。審査の開始は行わないとも述べています。

それでも、モデルナは同レターがワクチン自体の安全性や有効性に関する懸念を示すものではなく、問題は第3相有効性試験で使用した比較対象(コンパレーター)に起因すると述べています。
トレーダーにとって、それだけでMRNA株が急速に動くには十分です。主要な製品のタイムラインが不透明になると、市場はリスクを速やかに再評価する傾向があり、特に流動性が薄い時間外取引では顕著です。
| 項目 | 水準 / 詳細 |
|---|---|
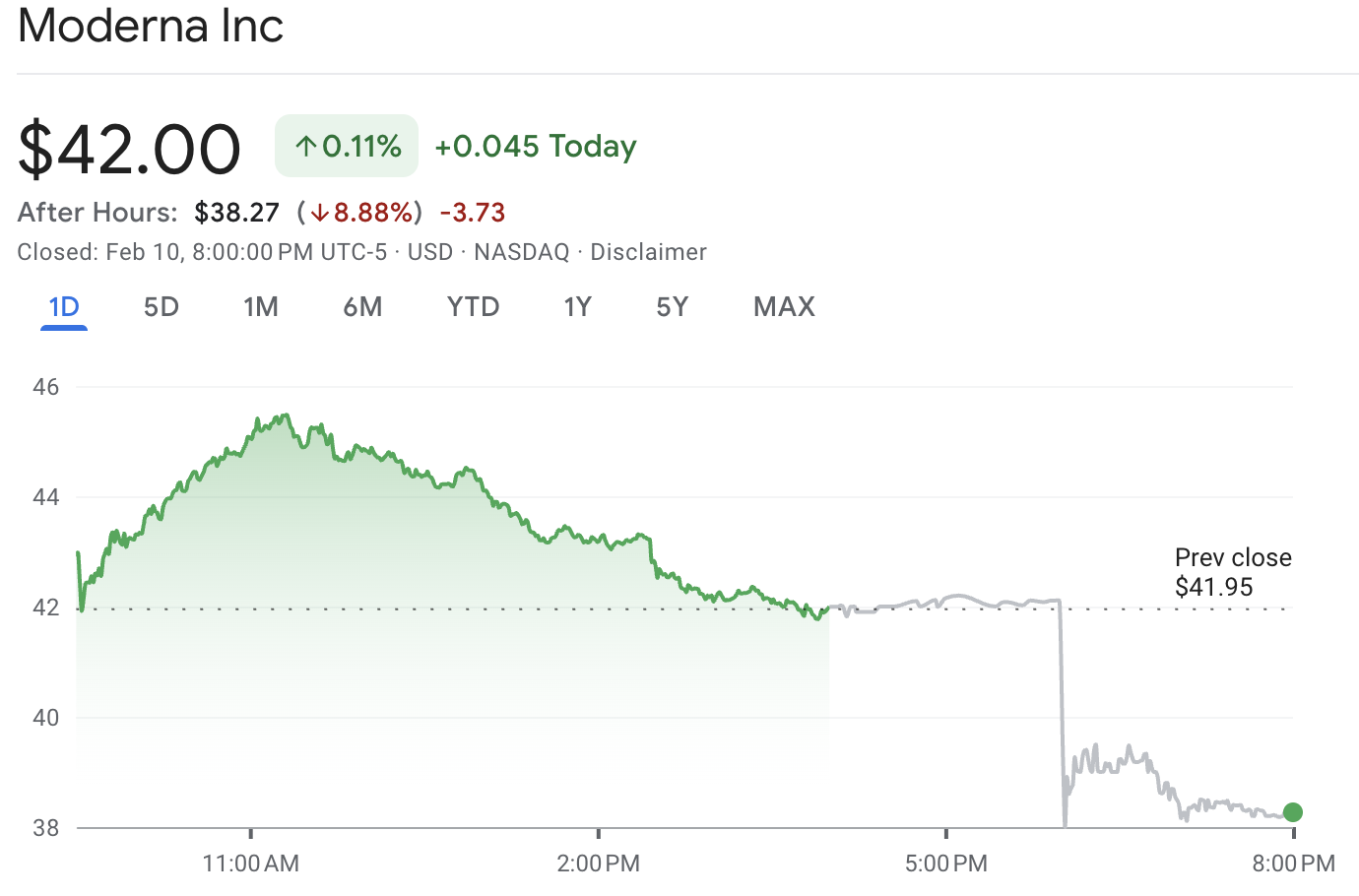
| 通常取引の終値 | ~$42.00 |
| 時間外値(例) | ~$38.27 (-8.88%) |
| 当日のレンジ | ~$41.68 ~ ~$45.50 |
| 52週レンジ | ~$22.28 ~ ~$55.20 |
MRNA株は約$42.00で引けた後、時間外取引で約$38.27まで下落し、報告時点で約8.9%の下落を示しました。

モデルナは、FDAの生物製剤評価研究センター(CBER)からのレターを受領し、mRNA-1010の生物学的製剤承認申請(BLA)について審査を開始しないとされ、代わりに受理拒否(RTF)レターが出されると発表しました。
同社は、タイムリーな審査を確保するためにPriority Review Voucherを利用していたと強調しました。この受理拒否は、市場の視点では特に失望を招くもので、問題が単に「順番待ち」であるだけではないことを示唆しています。
さらにモデルナは、この拒否は第3相前および事前提出段階で得たFDAからのフィードバックと矛盾していると指摘しました。そのため、同社は今後の方針を明確にするためにType Aミーティングを要請しています。
RTFは、FDAが提出段階で不完全あるいは実質的な審査に適さないと判断した申請を、審査に時間を費やすことを避けるために用いる正式な手段です。
FDAの内部手続きでは、RTFは不完全な申請の不必要な審査を防ぐ方法として定義されています。RTFの措置は、申請者が完全な申請を提出して実質的な審査を受ける前に「重大な不足点(critical insufficiencies)」に対処する機会を与えることを強調しています。
トレーダーにとって重要な実務上のポイントは次の二点です:
RTFは、完全な審査を経た上での承認や否認とは同じではありません。
今後の道筋は、FDAが求める変更点と、同社が迅速に対応できる能力に左右されます。

複数の報道によれば、主要な問題は、比較対象群がFDAの考える最良の標準的治療(特に高齢者に対するもの)を反映しておらず、そのためFDAはモデルナの試験デザインを「適切かつ厳密に管理された(adequate and well-controlled)」ものとは見なさなかったことです。
報道によると、モデルナはmRNA-1010を標準用量の承認済みインフルエンザワクチンと比較しました。
一方で、FDAは特に65歳以上の高リスク集団が米国で一般的に接種される方法(しばしば強化型や高用量ワクチンが用いられる)により近い比較対象を期待していたことを示唆しました。
モデルナはこの対応に異議を唱えています。同社の声明では、RTFは安全性や有効性の問題を示しておらず、今回の決定は以前のFDAからのフィードバックと一貫していないと述べています。
FDAは、審査開始を拒否した唯一の理由として標準用量の比較対象を挙げました。
Modernaは、FDAが特定の安全性や有効性に関する懸念を指摘しなかったと述べました。
Modernaは今後の方針を明確にするため、FDA上級幹部とのType Aミーティングを要請しました。
Modernaは、この決定が自社の2026年の業績見通しに影響を与えるとは考えていないと述べました。
ワクチン試験において、比較対象は新製品の性能を評価するための「基準」製品です。規制当局が比較対象が実際の適切な標準を示していないと判断すると、提示された証拠が当局が解答を求める問いに答えていないと主張する可能性があります。
そのため、企業が新たな安全性の懸念はないと述べてもMRNA株が強く反応するのです。議論の焦点は「効果があるか?」から「提示された証拠は現時点でこの集団に対するFDAの基準を満たしているか?」に移ります。
またこれが、トレーダーがRTF見出しをしばしば「スケジュール上のイベント」として扱う理由でもあります。ワクチンは依然として市場に到達する可能性がありますが、時期の予測が難しくなります。
Modernaは、mRNA-1010が現在EU、カナダ、オーストラリアで審査中であると発表しました。同社は、現在の評価に基づき、これらの地域での最速の承認は2026年後半または2027年初めに発生すると予想しています。
米国では、次のステップはType Aミーティングの結果次第です。これにより、Modernaが追加データ、別のアプローチ、あるいはFDAの比較対象に関する期待を満たすように表現を修正したうえで生物製剤承認申請(BLA)を再提出する必要があるかが決まります。
MRNAは、ポストCOVIDの将来が単一製品ではなくポートフォリオに基づくものであると投資家に納得させようとしてきました。インフルエンザはこのストーリーの中心であり、季節性の呼吸器市場は規模が大きく、反復性があり、商業的に実証されています。
このFDAによる審査開始拒否は、3つの面でMRNA株の評価にリセットを迫ります:
たとえ問題が解決可能でも、RTFは現時点でModernaに進行中のFDA審査がないことを意味します。それだけで短期の可視性を低下させ、「データ」と「収益」の間のギャップを拡大します。
Modernaは、FDAが審査を進める前にインフルエンザの有効性に関する追加データを求めたため、mRNA-1083(インフルエンザとCOVIDの組み合わせワクチン)に関するFDAへの申請を取り下げた経緯があります。市場はすでにModernaの呼吸器ワクチンのスケジュールが一度遅延するのを見ています。
もしFDAが高齢者に対して「最良の利用可能な標準治療」の比較対象を強調しているのであれば、これは単一プログラムの問題ではありません。今後、企業がインフルエンザ試験をどのように設計するか、そしてどれだけ速く改良を重ねられるかに影響を与える可能性があります。
MRNAの次回予定決算発表日は2026年2月13日で、オプション価格はそのイベント期間に向け週次の想定変動幅を約11.63%と見込んでいます。
想定変動幅が10%を超える場合、通常は投資家が見出しやガイダンス、あるいはその両方に関して重大な不確実性を期待していることを示します。
FDAによる審査開始拒否(refusal-to-file)事象の後、市場はしばしば次の二つを行う:
今後の方針やタイムラインについて、より明確な説明を求めます。
追随するコミュニケーション(例えばFDAミーティングの結果)が同時期に発表されると見なした場合、インプライド・ボラティリティを再価格化します。
| 指標 | 値 | シグナル |
|---|---|---|
| RSI (14) | 48.155 | 中立 |
| MACD (12,26) | 0.29 | 買い |
| ATR (14) | 0.9374 | 高いボラティリティ |
| ADX (14) | 40.829 | 売り |
MRNAのデイリーのテクニカルの姿勢は概ね中立で、時間外の動きがあった時点では指標や移動平均に混在したシグナルが見られました。
| レベルの種類 | 価格レベル | 見出し発生後にトレーダーがよく使う方法 |
|---|---|---|
| S1 | $41.74 | テープ(価格)が安定すればディップ買いが試す最初のエリア。 |
| S2 | $41.31 | これを下回ると、より下方のサポートを再テストする可能性が高まる。 |
| S3 | $40.51 | 長期の移動平均の混雑帯付近に位置するため、重要な「ライン」である。 |
| ピボット | $42.54 | ピボットを回復することは、市場がパニックを和らげつつあるサインであることが多い。 |
| R1 | $42.97 | 株価が決算に向けて反発した場合の最初の上値チェックポイント。 |
| R2 | $43.77 | より強い反発ゾーンで、しばしばファンダメンタルの明確化が必要となる。 |
通常取引時間中にMRNA株が40ドル台前半で踏みとどまれば、買い手がトレンドを守っていることを示唆します。
時間外の弱さが翌セッションに持ち越され、価格が主要な移動平均線を下回ったままであれば、新たな情報が出るまで市場センチメントは脆弱なままである可能性があります。
なぜ本日の時間外でMRNA株は下落したのですか?
MRNA株が時間外取引で下落したのは、Modernaが、mRNA-1010インフルエンザワクチンのBLAについてFDAが受理拒否(RTF)レターを発出し、審査を開始しないと伝えたことを受けたためです。
FDAはModernaのインフルワクチンを安全でないと言ったのですか?
いいえ。Modernaの声明によれば、受理拒否(RTF)レターはmRNA-1010に関する具体的な安全性懸念を指摘していないとされています。
なぜFDAはコンパレーター(比較ワクチン)に注目したのですか?
比較ワクチンは性能を判断するためのベンチマークだからであり、FDAは使用されたコンパレーターが特に高齢者に対する「最良の標準治療」を反映していないと述べました。
Modernaはこれが2026年の見通しに影響すると予想していますか?
Modernaは、受理拒否の決定が2026年の財務見通しに影響を与えるとは予想していないと述べました。それでも投資家がMRNA株を売った理由は、米国でのインフルエンザプログラムのタイミングが長期的な収益の可視性にとって重要だからです。
Modernaは米国外で承認を得られる可能性はありますか?
はい。ModernaはこのワクチンがEU、カナダ、オーストラリアで審査受理されたと発表しており、承認は2026年末から2027年初頭にかけて始まる可能性があると見込まれています。
結論として、MRNA株が時間外で下落したのは、ModernaのmRNAインフルエンザワクチン申請に対しFDAが受理拒否(RTF)レターを出し、米国でのスケジュールに関して短期的な不確実性が生じたためです。
重要なのは、このMRNA株の動きが新たに明らかになった安全性の問題ではなく、規制手続きや試験デザインの基準に関するものだという点です。
次の注視点は、ModernaがFDAのType Aミーティングを通じて明確な前進の道筋を確保できるか、そしてその道筋に新たな臨床試験が必要かどうかです。その明確性が得られるまでは、MRNA株は次の決算期までニュースに敏感でボラティリティの高い銘柄として取引される可能性が高いです。
免責事項:本資料は一般的な情報提供のみを目的としており、依拠すべき財務・投資その他の助言を意図するものではなく、そのように見なされるべきではありません。本資料に記載された意見はいかなる特定の投資、証券、取引、または投資戦略が特定の個人に適しているというEBCまたは著者による推奨を構成するものではありません。