Акции MRNA подешевели в послеурочное время, потому что FDA поставило жесткий крест на программе, которую инвесторы считали одним из наиболее реалистичных «следующих продуктов» Moderna за пределами её COVID‑франшизы.
Центр по оценке и контролю биологических препаратов (CBER) агентства выпустил письмо об отказе в приеме к рассмотрению (Refusal-to-File, RTF) в отношении заявки Moderna на лицензию на биопрепарат (BLA) для её исследуемой сезонной вакцины против гриппа mRNA-1010. В письме также указано, что обзор начат не будет.

Несмотря на это, Moderna заявляет, что в письме не содержалось замечаний по безопасности или эффективности самой вакцины и что проблема связана с компаратором, использованным в её фазе 3 исследования эффективности.
Для трейдеров этого достаточно, чтобы быстро сдвинуть котировки. Когда ключевые сроки по продукту становятся менее определёнными, рынки склонны быстро пересматривать риск, особенно в послеурочной торговле, где ликвидность ниже.
Что произошло с акциями MRNA в после‑торговую сессию?
| Показатель |
Уровень / подробности |
| Закрытие обычной сессии |
~$42.00 |
| Послеурочная цена (пример) |
~$38.27 (-8.88%) |
| Дневной диапазон |
~$41.68 до ~$45.50 |
| Диапазон за 52 недели |
~$22.28 до ~$55.20 |
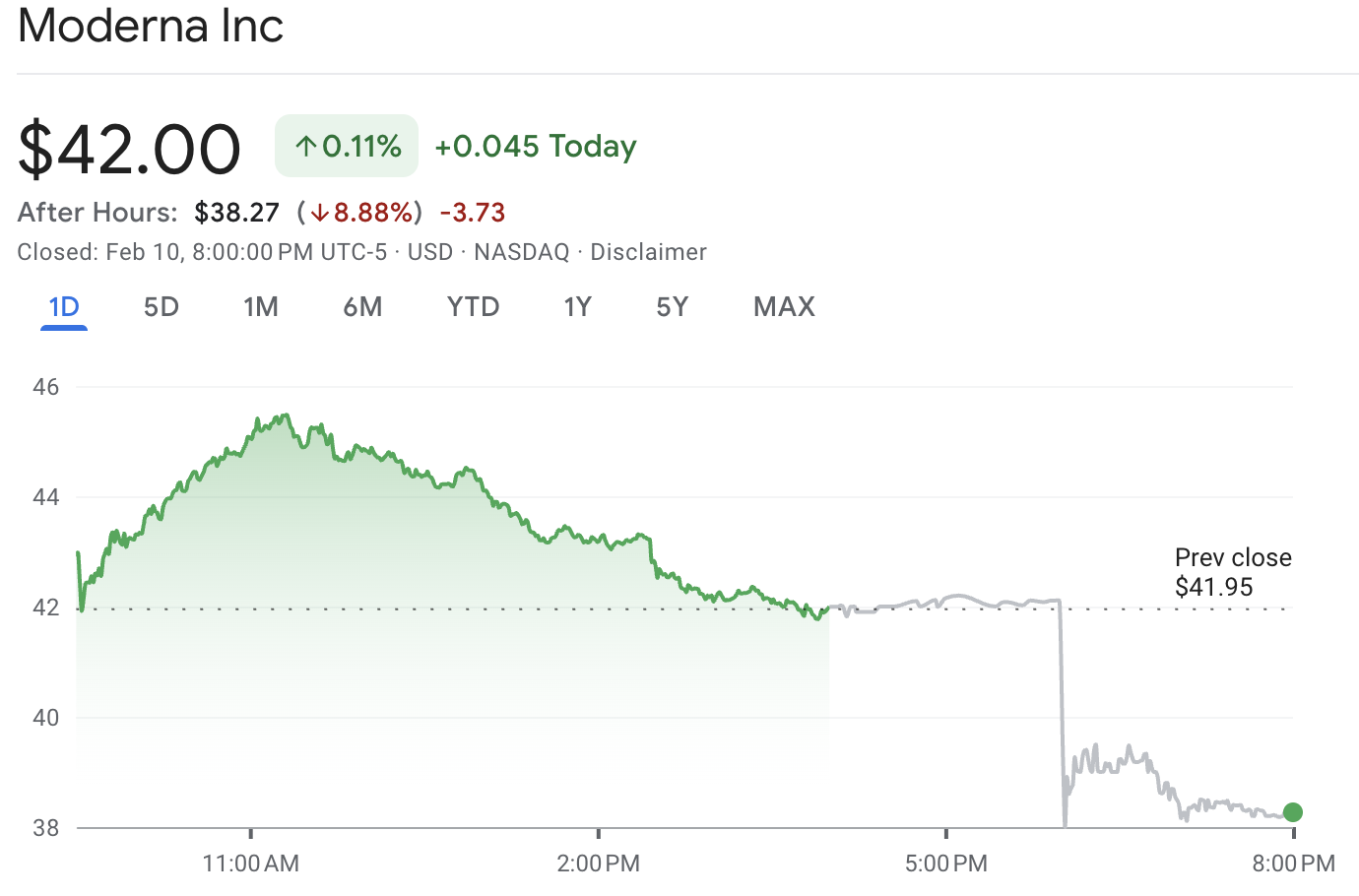
Акции MRNA закрылись примерно на уровне $42.00, а затем упали до около $38.27 в послеурочной торговле, что на момент отчёта составляло снижение примерно на 8.9%.
Что стало главным катализатором?

FDA отказало в приёме заявки Moderna на вакцину от гриппа
Moderna объявила, что получила письмо от Центра по оценке и контролю биологических препаратов (CBER) при FDA, в котором говорится, что обзор BLA на mRNA-1010 начат не будет и вместо этого будет направлено письмо Refusal to File (RTF).
Компания подчеркнула, что использовала приоритетный ваучер на обзор (Priority Review Voucher), чтобы обеспечить своевременное рассмотрение. Этот отказ особенно разочаровывает для Moderna с точки зрения рынка, поскольку он указывает на то, что проблема не сводится просто к «нахождению в очереди».
Кроме того, Moderna указала, что этот отказ противоречит отзывам, полученным в ходе консультаций до фазы 3 и до подачи заявки. В результате компания запросила встречу типа A (Type A meeting), чтобы прояснить дальнейшую стратегию.
Что такое письмо об отказе в приеме к рассмотрению?
RTF — это формальный механизм, который FDA использует, чтобы не тратить время на рассмотрение заявок, которые считает неполными или непригодными для содержательного обзора на этапе подачи.
Внутренняя процедура FDA определяет RTF как способ предотвратить ненужное рассмотрение неполных заявок. Она подчёркивает, что действие RTF позволяет заявителям устранить «критические недостатки» перед повторной подачей полноценной заявки, которая затем может пройти содержательный обзор.
Для трейдеров важны два практических момента:
RTF — это не то же самое, что полное одобрение или отклонение после завершённого рассмотрения.
Дальнейший путь зависит от запрошенных FDA изменений и способности компании оперативно на них отреагировать.
Почему FDA отказало Moderna в приёме заявки на вакцину против гриппа?

Ключевая проблема, о которой сообщают различные издания, заключается в том, что FDA не сочло дизайн исследования Moderna «адекватным и хорошо контролируемым», поскольку компаратор в исследовании не отражал, по мнению FDA, лучший доступный стандарт оказания медицинской помощи, особенно для пожилых людей.
Согласно сообщениям, Moderna сравнивала mRNA-1010 со стандартной лицензированной вакциной против гриппа (в освещении часто упоминали Fluarix от GSK).
В то же время FDA дало понять, что ожидало компаратор, который лучше соответствует тому, как обычно вакцинируют группы высокого риска, особенно лиц в возрасте 65 лет и старше, в США (часто используются усиленные или высокодозные варианты).
Moderna оспаривает это решение. В своём заявлении компания сообщила, что RTF не содержало замечаний по безопасности или эффективности и охарактеризовала решение как противоречащее ранее полученным отзывам FDA.
Ключевые заявления Moderna (из её пресс‑релиза)
FDA назвала компаратор стандартной дозы единственной причиной отказа от начала рассмотрения.
Moderna заявила, что FDA не указало конкретных проблем с безопасностью или эффективностью.
Moderna запросила встречу Type A с руководством FDA, чтобы прояснить дальнейший путь.
Moderna заявила, что не ожидает влияния этого решения на свои финансовые прогнозы на 2026 год.
Почему проблема компаратора критична?
В клинических испытаниях вакцин компаратор — это «эталонный» продукт, используемый для оценки эффективности нового препарата. Если регулятор считает, что компаратор не отражает правильный стандарт в реальной практике, он может утверждать, что представленные данные не отвечают на необходимый ему вопрос.
Именно поэтому рынки реагируют резко даже когда компания говорит, что новых проблем с безопасностью нет. Спор переводит дискуссию с «Работает ли это?» на «Соответствуют ли доказательства стандартам FDA для этой популяции в настоящий момент?»
Это также объясняет, почему трейдеры часто воспринимают заголовки об RTF как «события, влияющие на график». Вакцина все еще может выйти на рынок, но сроки становятся менее предсказуемыми.
Что это значит для сроков запуска грипповой вакцины Moderna
Moderna объявила, что mRNA-1010 в настоящее время проходит рассмотрение в ЕС, Канаде и Австралии. Компания ожидает, что первые одобрения в этих регионах могут произойти в конце 2026 года или в начале 2027 года, исходя из текущих оценок.
В Соединенных Штатах дальнейшие шаги будут зависеть от результатов встречи Type A. Это определит, потребуется ли Moderna повторно подать Biologics License Application (BLA) с дополнительными данными, другим подходом или изменённой формулировкой, соответствующей ожиданиям FDA относительно компараторов.
Почему реакция акций MRNA была такой быстрой: это вновь обнажает знакомую проблему Moderna
MRNA пытается убедить инвесторов, что её пост-COVID будущее строится на портфеле продуктов, а не на одном препарате. Грипп является ключевой частью этого нарратива, поскольку сезонные респираторные рынки большие, повторяющиеся и коммерчески доказанные.
Этот отказ FDA требует переоценки по трём направлениям.
1) Откладывает краткосрочный путь к запуску в США
Даже если проблему можно решить, RTF означает, что в настоящее время у Moderna нет активного рассмотрения FDA. Это само по себе снижает краткосрочную прозрачность и увеличивает разрыв между «данными» и «доходом».
2) Увеличивает неопределённость вокруг комбинированной респираторной стратегии Moderna
Moderna отозвала подачу в FDA на комбинированную вакцину mRNA-1083 против гриппа и COVID после того, как FDA запросило дополнительные данные по эффективности против гриппа перед продолжением рассмотрения. Эта история важна, потому что рынок уже наблюдал, как сроки разработки респираторной вакцины Moderna сдвигались однажды.
3) Сигнализирует ужесточение требований к компараторам для респираторных вакцин
Если FDA сейчас делает упор на компараторах, соответствующих «лучшей доступной стандартной терапии» для пожилых людей, это не проблема одного лишь проекта. Это может повлиять на то, как компании будут разрабатывать будущие клинические испытания против гриппа и как быстро они смогут вносить изменения.
Почему этот заголовок может повлиять на следующую реакцию рынка на отчётность
Следующая запланированная дата публикации результатов MRNA — 13 февраля 2026 года, и цены опционов прогнозируют недельное подразумеваемое движение примерно на 11.63% в рамках этого события.
Подразумеваемое движение выше 10% обычно говорит о том, что инвесторы ожидают существенной неопределённости в отношении заголовков, прогнозов или того и другого.
После события «отказа принять к рассмотрению» со стороны FDA рынок часто делает две вещи:
Требует более чёткой формулировки дальнейшего плана и сроков.
Пересматривает оценку подразумеваемой волатильности, если ожидает, что последующие сообщения, такие как результаты встречи с FDA, появятся примерно в тот же временной интервал.
Технический анализ акций MRNA: уровни, за которыми трейдерам стоит следить сегодня вечером
| Индикатор |
Значение |
Сигнал |
| RSI (14) |
48.155 |
Нейтрально |
| MACD (12,26) |
0.29 |
Покупать |
| ATR (14) |
0.9374 |
Высокая волатильность |
| ADX (14) |
40.829 |
Продавать |
Техническая картина MRNA за день была в целом нейтральной, с противоречивыми сигналами по индикаторам и скользящим средним на момент послеторгового движения.
Уровни Pivot (классические)
| Тип уровня |
Ценовой уровень |
Как трейдеры часто используют его после заголовка |
| Классический S1 |
$41.74 |
Первая область, где покупатели на откате могут войти, если лента стабилизируется. |
| Классический S2 |
$41.31 |
Пробой вниз повышает шансы на повторное тестирование более глубоких уровней поддержки. |
| Классический S3 |
$40.51 |
Ключевая «линия», поскольку она находится рядом с зоной скопления долгосрочных скользящих средних. |
| Классический Pivot |
$42.54 |
Возврат выше пивота часто сигнализирует о том, что рынок отходит от паники. |
| Классический R1 |
$42.97 |
Первая контрольная точка роста, если акции отскочат в преддверии отчетности. |
| Классический R2 |
$43.77 |
Более сильная зона восстановления, которая часто требует фундаментального прояснения. |
Как интерпретировать эту ситуацию:
Если акции удерживаются выше нижней части зоны $40 в обычные торговые часы, это указывает на то, что покупатели по-прежнему защищают тренд.
Если слабость, проявившаяся в послеторговые часы, сохранится в следующей сессии и цена останется ниже ключевых скользящих средних, рыночный настрой может оставаться хрупким до появления новой информации.
Часто задаваемые вопросы (FAQ)
Почему акции MRNA сегодня упали в послеторговые часы?
В послеторговые часы акции MRNA упали после объявления Moderna о том, что FDA направило письмо об отказе в приеме заявки (refusal-to-file) для заявки BLA на противогриппозную вакцину mRNA-1010, указав, что FDA не начнет обзор.
Сказало ли FDA, что вакцина Moderna от гриппа небезопасна?
Нет. В заявлении Moderna говорится, что письмо об отказе в приеме не выявляло конкретных проблем по безопасности mRNA-1010.
Почему FDA сфокусировалось на вакцине-компараторе?
Потому что компаратор служит эталоном для оценки эффективности, и FDA заявило, что использованный компаратор не отражал «наилучший доступный стандарт медицинской помощи», особенно для пожилых людей.
Ожидает ли Moderna, что это изменит её прогноз на 2026 год?
Moderna заявила, что не ожидает никакого влияния решения об отказе в приеме на её финансовый прогноз на 2026 год. Тем не менее инвесторы продавали акции, поскольку сроки запуска программы по гриппу в США важны для видимости долгосрочных доходов.
Может ли Moderna всё ещё получить одобрение за пределами Соединённых Штатов?
Да. Moderna объявила, что заявка принята к рассмотрению в ЕС, Канаде и Австралии, и потенциальные одобрения ожидаются с конца 2026 года или в начале 2027 года.
Вывод
В заключение, акции MRNA снизились в послеторговые часы, потому что FDA направило письмо об отказе в приеме заявки для противогриппозной вакцины Moderna mRNA, что создаёт краткосрочную неопределённость в отношении сроков в США.
Главный момент в том, что это движение связано с регуляторным процессом и требованиями к дизайну испытаний, а не с выявленной проблемой безопасности.
Следующий фактор, способный изменить динамику, — это не дебаты об иммунологии гриппа. Следующий фактор — сможет ли Moderna обеспечить чёткий путь вперёд через встречу типа A с FDA и потребует ли этот путь новых клинических работ. Пока этого прояснения нет, акции MRNA, вероятно, будут торговаться как чувствительная к заголовкам и высоковолатильная бумага до следующего окна отчетности.
Отказ от ответственности: Этот материал предназначен только для общей информации и не является (и не должен рассматриваться как) финансовым, инвестиционным или иным советом, на который следует полагаться. Ни одно из мнений, выраженных в материале, не представляет собой рекомендацию EBC или автора о том, что какое-либо конкретное вложение, ценная бумага, сделка или инвестиционная стратегия подходит какому-либо конкретному лицу.





























