ट्रेडिंग
ईबीसी के बारे में
प्रकाशित तिथि: 2026-02-11
MRNA स्टॉक बाद के घंटों में नीचे है क्योंकि FDA ने उस कार्यक्रम पर कड़ा रोक लगा दी जिसे निवेशक मॉडर्ना का COVID फ्रैंचाइज़ के बाद सबसे यथार्थवादी 'अगला उत्पाद' ब्रिजों में से एक मानते थे।
एजेंसी के बायोलॉजिक्स मूल्यांकन और अनुसंधान केंद्र (CBER) ने मॉडर्ना के जाँचाधीन मौसमी इन्फ्लुएंजा वैक्सीन mRNA-1010 के लिए बायोलॉजिक्स लाइसेंस आवेदन (BLA) पर Refusal-to-File (RTF) पत्र जारी किया। इसने कहा कि वह समीक्षा शुरू नहीं करेगी।

इसके बावजूद, मॉडर्ना का कहना है कि पत्र ने स्वयं वैक्सीन की सुरक्षा या प्रभावकारिता संबंधी चिंताएँ नहीं उठाईं, और मुद्दा इसकी Phase 3 प्रभावकारिता अध्ययन में इस्तेमाल किए गए परीक्षण तुलनाकारक से जुड़ा है।
ट्रेडर्स के लिए, यह स्टॉक को जल्दी हिलाने के लिए पर्याप्त है। जब किसी प्रमुख उत्पाद की समय-रेखा कम स्पष्ट हो जाती है, तो बाजार जल्दी जोखिम का पुनर्मूल्यांकन करते हैं, खासकर विस्तारित ट्रेडिंग में जब तरलता कम होती है।
| आइटम | स्तर / विवरण |
|---|---|
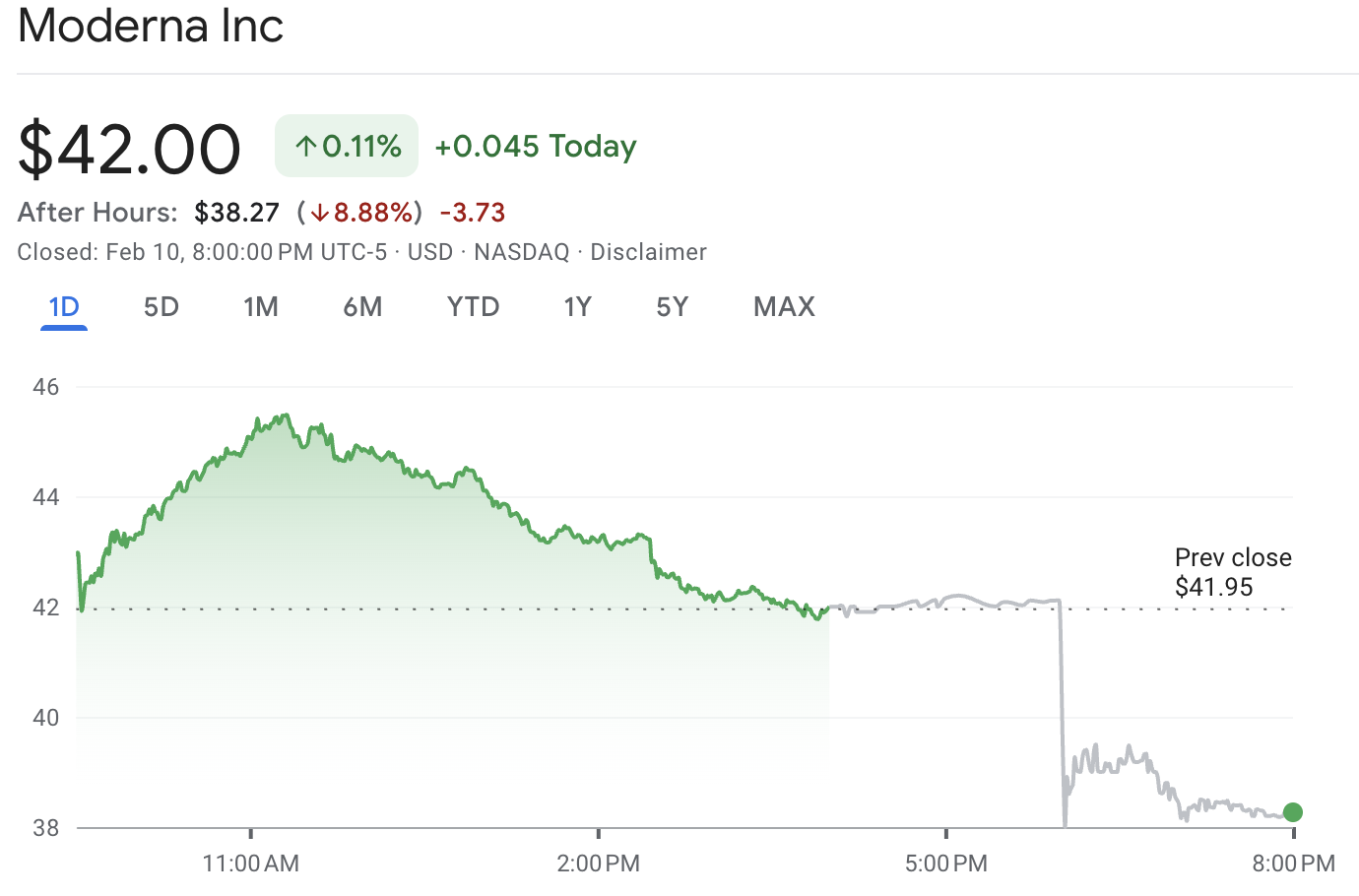
| नियमित सत्र का समापन | ~$42.00 |
| बाद के घंटों का आंकड़ा (उदाहरण) | ~$38.27 (-8.88%) |
| दिन की सीमा | ~$41.68 से ~$45.50 |
| 52-सप्ताह की सीमा | ~$22.28 से ~$55.20 |
MRNA स्टॉक लगभग $42.00 पर बंद हुआ, जिसके बाद बाद के घंटों के व्यापार में यह लगभग $38.27 तक गिर गया, जो रिपोर्ट के समय लगभग 8.9% की गिरावट दर्शाता है।

मॉडर्ना ने घोषणा की कि उसे FDA के बायोलॉजिक्स मूल्यांकन और अनुसंधान केंद्र (CBER) से एक पत्र प्राप्त हुआ है, जिसमें कहा गया है कि यह mRNA-1010 के बायोलॉजिक्स लाइसेंस आवेदन (BLA) की समीक्षा शुरू नहीं करेगा और इसके बजाय एक Refusal to File (RTF) पत्र जारी करेगा।
कंपनी ने बताया कि उसने समय पर समीक्षा सुनिश्चित करने में मदद के लिए एक प्राथमिक समीक्षा वाउचर (Priority Review Voucher) का उपयोग किया था। यह अस्वीकृति बाजार के लिहाज से मॉडर्ना के लिए खासतौर पर निराशाजनक है, क्योंकि इससे संकेत मिलता है कि समस्या केवल 'क्यू में होने' का मामला नहीं है।
अतिरिक्त रूप से, मॉडर्ना ने संकेत दिया कि यह इनकार उन फीडबैक के विरुद्ध है जो उसे प्री-Phase 3 और प्री-सबमिशन परामर्शों के दौरान प्राप्त हुए थे। परिणामस्वरूप, कंपनी ने आगे का मार्ग स्पष्ट करने के लिए एक Type A बैठक का अनुरोध किया है।
RTF एक औपचारिक उपकरण है जिसका उपयोग FDA उन आवेदनों की समीक्षा में समय बर्बाद करने से बचने के लिए करता है जिन्हें यह अधूरा या फाइलिंग चरण में सार्थक समीक्षा के योग्य नहीं मानता।
FDA की आंतरिक प्रक्रिया RTF को अधूरे आवेदनों की अनावश्यक समीक्षा रोकने की एक पद्धति के रूप में परिभाषित करती है। यह रेखांकित करता है कि RTF कार्रवाई आवेदकों को 'महत्वपूर्ण अपर्याप्तताओं' को संबोधित करने की अनुमति देती है इससे पहले कि वे एक पूर्ण आवेदन प्रस्तुत करें, जिसे फिर सारगर्भित समीक्षा के लिए लिया जा सकता है।
ट्रेडर्स के लिए दो व्यावहारिक बातें मायने रखती हैं:
RTF पूर्ण समीक्षा के बाद दिए गए पूर्ण अनुमोदन या अस्वीकृति के समान नहीं है।
आगे का रास्ता FDA द्वारा अनुरोधित परिवर्तनों और कंपनी की त्वरित प्रतिक्रिया देने की क्षमता पर निर्भर करता है।

कई रिपोर्टों में वर्णित के अनुसार केंद्रीय मुद्दा यह है कि FDA ने मॉडर्ना के अध्ययन डिज़ाइन को 'पर्याप्त और अच्छी तरह नियंत्रित' नहीं माना क्योंकि तुलनाकारक आर्म FDA की नजर में उपलब्ध सर्वोत्तम मानक देखभाल को प्रतिबिंबित नहीं करता था, विशेषकर बुजुर्गों के लिए।
रिपोर्टिंग के अनुसार, मॉडर्ना ने mRNA-1010 की तुलना एक मानक-डोज लाइसेंस प्राप्त फ्लू वैक्सीन के साथ की (कवरेज में अक्सर GSK की Fluarix के रूप में उद्धृत)।
एक ही समय में, FDA ने संकेत दिया कि वह एक ऐसा तुलनाकारक अपेक्षित करता था जो उच्च जोखिम वाले आबादी, विशेषकर 65 वर्ष और उससे अधिक आयु के लोगों के लिए सामान्यतः संयुक्त राज्य अमेरिका में किए जाने वाले टीकाकरण के अनुरूप हो (अक्सर एन्हांस्ड या हाई-डोज विकल्प के साथ)।
मॉडर्ना इस कदम का विरोध करता है। अपनी घोषणा में कंपनी ने कहा कि RTF ने सुरक्षा या प्रभावकारिता संबंधी मुद्दे का उल्लेख नहीं किया और इस फैसले को पहले प्राप्त FDA फीडबैक के अनुरूप नहीं बताया।
FDA ने समीक्षा शुरू करने से इंकार करने का एकमात्र कारण मानक-खुराक तुलना बताया।
Moderna ने कहा कि FDA ने कोई विशिष्ट सुरक्षा या प्रभावशीलता संबंधी चिंताएँ नहीं बताईं।
Moderna ने FDA नेतृत्व के साथ आगे का रास्ता स्पष्ट करने के लिए Type A बैठक का अनुरोध किया।
Moderna ने कहा कि उसे उम्मीद नहीं है कि यह निर्णय उसकी 2026 वित्तीय मार्गदर्शिका को प्रभावित करेगा।
टीके के परीक्षणों में, तुलनात्मक उत्पाद वह "बेसलाइन" उत्पाद होता है जिसका उपयोग नए उत्पाद के प्रदर्शन का आकलन करने के लिए किया जाता है। यदि नियामक मानता है कि तुलनात्मक उत्पाद वास्तविक दुनिया के सही मानक का प्रतिनिधित्व नहीं करता, तो वह तर्क दे सकता है कि उपलब्ध साक्ष्य उस प्रश्न का उत्तर नहीं देते जिसकी उसे आवश्यकता है।
इसीलिए बाजार तीव्रता से प्रतिक्रिया देते हैं भले ही कंपनी कहे कि कोई नया सुरक्षा संबंधी चिंता नहीं है। विवाद बहस को "क्या यह काम करता है?" से बदलकर "क्या साक्ष्य इस आबादी के लिए अभी FDA के मानक को पूरा करते हैं?" में ले आता है।
यह यह भी समझाता है कि व्यापारी अक्सर RTF हेडलाइन को "समय-रेखा घटनाएँ" के रूप में क्यों मानते हैं। वैक्सीन फिर भी बाजार में पहुँच सकती है, लेकिन समय कम अनुमानित हो जाता है।
Moderna ने घोषणा की कि mRNA-1010 वर्तमान में EU, Canada, और Australia में समीक्षा के अधीन है। कंपनी का अनुमान है कि इन क्षेत्रों में सबसे पहले मंजूरियाँ वर्तमान आकलनों के आधार पर देर 2026 या शुरुआत 2027 में हो सकती हैं।
संयुक्त राज्य में, अगले कदम Type A बैठक के नतीजे पर निर्भर करेंगे। इससे तय होगा कि क्या Moderna को अतिरिक्त डेटा, एक अलग तरीका, या FDA की तुलनात्मक अपेक्षाओं को पूरा करने वाली संशोधित प्रस्तुति के साथ Biologics License Application (BLA) पुनः प्रस्तुत करनी होगी।
MRNA निवेशकों को यह विश्वास दिलाने की कोशिश कर रहा है कि इसका पोस्ट‑COVID भविष्य एक पोर्टफोलियो पर आधारित है, न कि किसी एक उत्पाद पर। फ्लू उस कहानी का केंद्र है क्योंकि मौसमी श्वसन बाजार बड़े, आवर्ती और व्यावसायिक रूप से प्रमाणित हैं।
यह FDA की अस्वीकृति तीन मोर्चों पर रीसेट की माँग करती है।
भले ही यह मुद्दा सुलझाया जा सके, एक RTF का मतलब है कि वर्तमान में Moderna के पास सक्रिय FDA समीक्षा नहीं चल रही है। यही निकट‑कालीन दृश्यता को घटाता है और "data" और "revenue" के बीच का अंतर बढ़ा देता है।
FDA ने समीक्षा आगे बढ़ाने से पहले फ्लू प्रभावशीलता पर अधिक डेटा का अनुरोध किया था, जिसके बाद Moderna ने mRNA-1083 फ्लू और COVID संयोजन वैक्सीन के लिए अपनी FDA फाइलिंग वापस ले ली। यह इतिहास मायने रखता है क्योंकि बाजार पहले ही एक बार Moderna की श्वसन समयरेखा के स्थगन को देख चुका है।
यदि FDA अब वृद्ध वयस्कों के लिए "उपलब्ध सर्वश्रेष्ठ देखभाल मानक" तुलनात्मक उत्पादों पर ज़ोर दे रहा है, तो यह किसी एक कार्यक्रम की समस्या नहीं है। यह प्रभावित कर सकता है कि कंपनियाँ भविष्य के इन्फ्लुएंजा ट्रायल कैसे डिजाइन करेंगी और वे कितनी तेज़ी से पारितोषिक कर सकती हैं।
MRNA की अगली निर्धारित आय (earnings) तिथि 13 फरवरी, 2026 है, और ऑप्शन्स की प्राइसिंग उस इवेंट विंडो में लगभग 11.63% साप्ताहिक निहित चाल की उम्मीद करती है।
10% से ऊपर की निहित चाल आमतौर पर बताती है कि निवेशक हेडलाइन, मार्गदर्शन, या दोनों के आसपास महत्वपूर्ण अनिश्चितता की उम्मीद करते हैं।
FDA के फाइल करने से इंकार करने की घटना के बाद, बाजार अक्सर दो चीजें करता है:
यह आगे के रास्ते और समय‑रेखा पर स्पष्ट भाषा की मांग करता है।
यदि यह उम्मीद करता है कि फॉलो‑अप संवाद, जैसे FDA बैठक का परिणाम, उसी समय‑खिड़की के पास आएगा, तो यह निहित अस्थिरता (implied volatility) का पुनर्मूल्यांकन करता है।
| सूचक | मान | संकेत |
|---|---|---|
| RSI (14) | 48.155 | तटस्थ |
| MACD (12,26) | 0.29 | खरीद |
| ATR (14) | 0.9374 | उच्च अस्थिरता |
| ADX (14) | 40.829 | बेचना |
MRNA का दैनिक तकनीकी रुख व्यापक रूप से तटस्थ था, क्योंकि आफ्टर-आवर्स मूव के समय संकेतकों और मूविंग एवरेज में मिश्रित संकेत दिखाई दे रहे थे।
| स्तर प्रकार | मूल्य स्तर | शीर्षक के बाद व्यापारी अक्सर इसका कैसे उपयोग करते हैं |
|---|---|---|
| क्लासिक S1 | $41.74 | अगर बाजार स्थिर होता है तो डिप खरीददार सबसे पहले इसी क्षेत्र का परीक्षण कर सकते हैं। |
| क्लासिक S2 | $41.31 | इसके नीचे टूटने से गहरे सपोर्ट का पुन: परीक्षण होने की संभावना बढ़ जाती है। |
| क्लासिक S3 | $40.51 | यह एक महत्वपूर्ण "लाइन" है क्योंकि यह लंबे अवधि के मूविंग एवरेज के घनत्व के पास स्थित है। |
| क्लासिक पिवट | $42.54 | पिवट को वापस हासिल करना अक्सर संकेत देता है कि बाजार घबराहट को पीछे छोड़ रहा है। |
| क्लासिक R1 | $42.97 | यदि स्टॉक अर्निंग्स के बाद उबरता है तो पहला ऊपर की ओर चेकपॉइंट। |
| क्लासिक R2 | $43.77 | एक अधिक मजबूत रिबाउंड क्षेत्र जो अक्सर बुनियादी स्पष्टीकरण की मांग करता है। |
यदि स्टॉक सामान्य कारोबार घंटों के दौरान लो-$40 क्षेत्र से ऊपर बना रहता है, तो यह संकेत देता है कि खरीदार अभी भी प्रवृत्ति की रक्षा कर रहे हैं।
यदि आफ्टर-आवर्स की कमजोरी अगले सेशन में बनी रहती है और कीमत प्रमुख मूविंग एवरेज से नीचे रहती है, तो नई जानकारी आने तक बाजार का मनोबल नाजुक रह सकता है।
बाज़ार बंद होने के बाद, MRNA का स्टॉक गिर गया, जब Moderna ने घोषणा की कि FDA ने mRNA-1010 इन्फ्लुएंजा वैक्सीन के BLA के लिए फाइल करने से इंकार करने वाला पत्र जारी किया है, जिसका मतलब है कि FDA समीक्षा शुरू नहीं करेगा।
नहीं। Moderna के बयान में कहा गया है कि फाइल करने से इंकार करने वाले पत्र में mRNA-1010 के बारे में किसी विशिष्ट सुरक्षा चिंता का उल्लेख नहीं किया गया था।
क्योंकि तुलनात्मक दवा प्रदर्शन का मानक होती है, और FDA ने कहा कि उपयोग किया गया तुलनात्मक संदर्भ "उपलब्ध सर्वोत्तम देखभाल मानक" को नहीं दर्शाता था, खासकर बुज़ुर्गों के लिए।
Moderna ने कहा कि फाइल करने से इंकार के निर्णय से उसके 2026 वित्तीय मार्गदर्शन पर कोई प्रभाव होने की उम्मीद नहीं है। निवेशकों ने फिर भी स्टॉक बेचा क्योंकि फ्लू प्रोग्राम की यू.एस. समयरेखा लंबी अवधि की राजस्व दृश्यता के लिए महत्वपूर्ण है।
हाँ। Moderna ने घोषणा की कि वैक्सीन EU, कनाडा और ऑस्ट्रेलिया में समीक्षा के लिए स्वीकार कर ली गई है, और संभावित मंजूरियाँ देर 2026 या शुरुआती 2027 में होने की उम्मीद है।
निष्कर्ष यह है कि MRNA स्टॉक आफ्टर-आवर्स में इसलिए गिरा क्योंकि FDA ने Moderna की mRNA फ्लू वैक्सीन आवेदन के लिए फाइल करने से इंकार करने वाला पत्र जारी किया, जिससे यू.एस. समयरेखा के आसपास पास के समय के लिए अनिश्चितता बढ़ गई है।
मुख्य बात यह है कि यह कदम नियामक प्रक्रिया और ट्रायल डिज़ाइन मानकों के बारे में है, किसी नए खुलासे किए गए सुरक्षा समस्या के बारे में नहीं।
अगला निर्णायक कारक इन्फ्लुएंजा इम्यूनोलॉजी पर बहस नहीं है। अगला निर्णायक कारक यह है कि क्या Moderna FDA Type A बैठक के जरिए स्पष्ट मार्ग सुनिश्चित कर सकती है और क्या उस मार्ग के लिए नई क्लिनिकल काम की आवश्यकता होगी। जब तक वह स्पष्टता नहीं आती, MRNA स्टॉक अपने अगले अर्निंग्स विंडो तक हेडलाइन-संवेदनशील और उच्च अस्थिरता वाला बना रह सकता है।
अस्वीकरण: यह सामग्री केवल सामान्य जानकारी के उद्देश्य से है और इसे (और इसे माना नहीं जाना चाहिए) ऐसे वित्तीय, निवेश या अन्य परामर्श के रूप में नहीं लिया जाना चाहिए जिस पर निर्भर किया जाए। इस सामग्री में दी गई किसी भी राय को EBC या लेखक द्वारा किसी विशिष्ट व्यक्ति के लिए किसी विशेष निवेश, सुरक्षा, लेनदेन या निवेश रणनीति की सिफारिश नहीं माना जाना चाहिए।