As ações da MRNA estão em queda no pós-mercado porque a FDA impôs um bloqueio a um programa que os investidores tratavam como uma das pontes de "próximo produto" mais realistas da Moderna além de sua franquia de COVID.
O Center for Biologics Evaluation and Research (CBER) da agência emitiu uma carta de Refusal-to-File (RTF) para o pedido de licença para produtos biológicos (BLA) da Moderna para sua vacina sazonal investigacional contra influenza, mRNA-1010. Também afirmou que não iniciaria uma revisão.

Apesar disso, a Moderna diz que a carta não levantou preocupações de segurança ou eficácia sobre a vacina em si, e que a questão está relacionada ao comparador do ensaio utilizado em seu estudo de eficácia de Fase 3.
Para os operadores, isso é suficiente para mover o papel rapidamente. Quando um cronograma-chave de produto fica menos claro, os mercados tendem a recalibrar o risco rapidamente, especialmente na negociação estendida, quando a liquidez é mais baixa.
O que aconteceu com as ações da MRNA no pós-mercado?
| Item |
Nível / Detalhe |
| Fechamento da sessão regular |
~$42.00 |
| Cotação no pós-fechamento (exemplo) |
~$38.27 (-8.88%) |
| Intervalo do dia |
~$41.68 a ~$45.50 |
| Intervalo de 52 semanas |
~$22.28 a ~$55.20 |
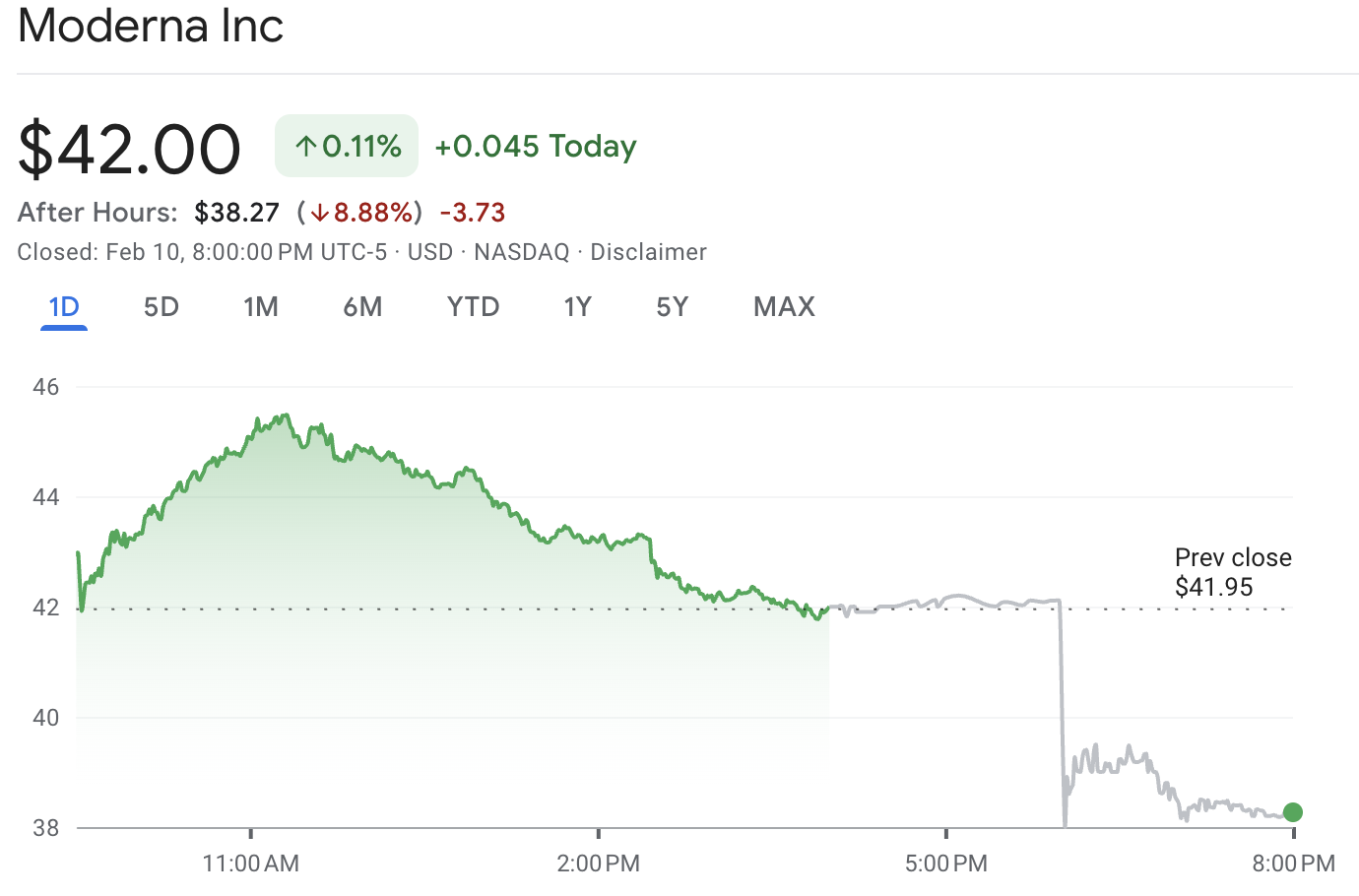
As ações da MRNA fecharam em aproximadamente $42.00 antes de caírem para cerca de $38.27 na negociação pós-fechamento, representando uma queda de cerca de 8,9% no momento do relatório.
Qual foi o principal catalisador?

A FDA recusou arquivar a aplicação da Moderna para a vacina da gripe
A Moderna anunciou que recebeu uma carta do Center for Biologics Evaluation and Research (CBER) da FDA, informando que não iniciará a revisão do Biologics License Application (BLA) do mRNA-1010 e que, em vez disso, emitirá uma carta de Refusal to File (RTF).
A empresa destacou que havia utilizado um voucher de revisão prioritária para ajudar a garantir uma revisão em tempo hábil. Essa rejeição é particularmente decepcionante para a Moderna do ponto de vista de mercado, pois sugere que a questão não é meramente estar "na fila".
Além disso, a Moderna indicou que essa recusa contradiz o feedback que recebeu durante as consultas pré-Fase 3 e pré-submissão. Consequentemente, a empresa solicitou uma reunião do Tipo A para esclarecer o caminho a seguir.
O que é uma carta de Refusal-To-File?
Uma RTF é uma ferramenta formal que a FDA usa para evitar gastar tempo revisando aplicações que considera incompletas ou não adequadas para uma revisão significativa na fase de arquivamento.
O procedimento interno da FDA define a RTF como um método para prevenir a revisão desnecessária de aplicações incompletas. Destaca que uma ação de RTF permite que os requerentes resolvam "insuficiências críticas" antes de submeterem uma aplicação completa, que então pode passar por revisão substantiva.
Dois pontos práticos importam para os operadores:
Uma RTF não é o mesmo que uma aprovação total ou rejeição após uma revisão completa.
O caminho a seguir depende das mudanças solicitadas pela FDA e da capacidade da empresa de responder rapidamente.
Por que a FDA disse não à vacina da gripe da Moderna?

A questão central, conforme descrito em vários relatórios, é que a FDA não considerou o desenho do estudo da Moderna como "adequado e bem controlado" porque o braço comparador não refletia a visão da FDA sobre o melhor padrão de cuidado disponível, particularmente para adultos mais velhos.
Segundo as reportagens, a Moderna comparou o mRNA-1010 com uma vacina contra gripe licenciada em dose padrão (frequentemente citada como a Fluarix da GSK na cobertura).
Ao mesmo tempo, a FDA sinalizou que esperava um comparador que correspondesse melhor à forma como populações de alto risco, especialmente as com 65 anos ou mais, costumam ser vacinadas nos Estados Unidos (frequentemente com opções reforçadas ou de alta dose).
A Moderna contesta a medida. Em seu comunicado, a empresa afirmou que a RTF não citou problemas de segurança ou eficácia e descreveu a decisão como inconsistente com o feedback anterior da FDA.
Principais alegações da Moderna (segundo seu comunicado)
A FDA citou o comparador de dose padrão como a única razão para recusar o início da revisão.
A Moderna afirmou que a FDA não identificou preocupações específicas de segurança ou eficácia.
A Moderna solicitou uma reunião do Tipo A com a liderança da FDA para esclarecer um caminho a seguir.
A Moderna afirmou que não espera que essa decisão afete sua orientação financeira para 2026.
Por que a Questão do Comparador é Crítica?
Em ensaios de vacinas, o comparador é o produto "de referência" usado para avaliar o desempenho do novo produto. Se o regulador acredita que o comparador não representa o padrão correto do mundo real, ele pode argumentar que as evidências não respondem à questão que precisa ser respondida.
É por isso que os mercados reagem fortemente mesmo quando a empresa diz que não há nova preocupação de segurança. A disputa desloca o debate de "Funciona?" para "As evidências cumprem o padrão da FDA para essa população neste momento?"
Isso também explica por que os operadores frequentemente tratam manchetes de RTF como "eventos de cronograma." A vacina ainda pode chegar ao mercado, mas o momento torna-se menos previsível.
O que Isso Significa para o Cronograma da Vacina Contra a Gripe da Moderna
A Moderna anunciou que o mRNA-1010 está atualmente em revisão na UE, Canadá e Austrália. A empresa antecipa que as primeiras aprovações nessas regiões ocorrerão no final de 2026 ou início de 2027, com base nas avaliações atuais.
Nos Estados Unidos, os próximos passos dependerão do resultado da reunião do Tipo A. Isso determinará se a Moderna precisará reapresentar o pedido de licença para produtos biológicos (BLA) com dados adicionais, uma abordagem diferente ou uma reformulação que atenda às expectativas da FDA quanto aos comparadores.
Por que a Reação das Ações da MRNA Foi Tão Rápida: Reabre uma Preocupação Conhecida da Moderna
A MRNA vem tentando convencer os investidores de que seu futuro pós-COVID é construído sobre um portfólio, não sobre um único produto. A gripe é central para essa narrativa porque os mercados respiratórios sazonais são amplos, recorrentes e comprovados comercialmente.
Essa recusa da FDA força um reinício em três frentes.
1) Adia uma Via de Lançamento de Curto Prazo nos EUA
Mesmo que a questão seja solucionável, um RTF significa que a Moderna não tem uma revisão ativa pela FDA em andamento hoje. Isso por si só reduz a visibilidade de curto prazo e aumenta a lacuna entre "dados" e "receita."
2) Aumenta a Incerteza em Torno da Estratégia Respiratória Combinada da Moderna
A Moderna retirou seu pedido junto à FDA para a vacina combinada mRNA-1083 contra gripe e COVID depois que a FDA solicitou mais dados sobre a eficácia contra a gripe antes de prosseguir com a revisão. Esse histórico importa porque o mercado já viu o cronograma respiratório da Moderna atrasar uma vez.
3) Sinaliza um Padrão Mais Rígido para Comparadores de Vacinas Respiratórias
Se a FDA agora está enfatizando comparadores de "melhor padrão de cuidado disponível" para adultos mais velhos, isso não é uma questão isolada de um único programa. Pode moldar como as empresas desenham futuros ensaios de influenza e com que rapidez podem iterar.
Por que Essa Manchete Pode Repercutir na Próxima Reação aos Resultados
A próxima data prevista para divulgação de resultados da MRNA é 13 de fevereiro de 2026, e o preço das opções antecipa um movimento implícito semanal de cerca de 11.63% nesse período.
Um movimento implícito acima de 10% geralmente indica que os investidores esperam incerteza significativa em relação a manchetes, orientação ou ambos.
Após um evento de recusa de arquivamento pela FDA, o mercado frequentemente faz duas coisas:
Exige linguagem mais clara sobre o caminho a seguir e os cronogramas.
Reprecifica a volatilidade implícita se esperar que uma comunicação de acompanhamento, como o resultado de uma reunião com a FDA, ocorra próximo do mesmo período.
Análise Técnica das Ações MRNA: Níveis que os Operadores Devem Observar Hoje à Noite
| Indicador |
Valor |
Sinal |
| RSI (14) |
48.155 |
Neutro |
| MACD (12,26) |
0.29 |
Compra |
| ATR (14) |
0.9374 |
Alta volatilidade |
| ADX (14) |
40.829 |
Venda |
A postura técnica diária da MRNA estava amplamente neutra, com sinais mistos entre os indicadores e médias móveis no momento do movimento após o expediente.
Níveis de Pivô (Clássico)
| Tipo de nível |
Nível de preço |
Como os traders frequentemente o usam após uma manchete |
| S1 Clássico |
$41.74 |
Primeira área onde compradores de queda podem testar se o pregão se estabiliza. |
| S2 Clássico |
$41.31 |
Um rompimento abaixo aumenta as chances de um reteste de suportes mais profundos. |
| S3 Clássico |
$40.51 |
Uma "linha" chave porque fica perto da congestão de médias móveis de prazo mais longo. |
| Pivô Clássico |
$42.54 |
Recuperar o pivô costuma sinalizar que o mercado está atenuando o pânico. |
| R1 Clássico |
$42.97 |
Primeiro ponto de verificação para o lado de alta se a ação se recuperar até os resultados. |
| R2 Clássico |
$43.77 |
Uma zona de recuperação mais forte que frequentemente requer esclarecimentos sobre fundamentos. |
Como Ler Esta Configuração:
Se a ação se mantiver acima da faixa inferior dos US$ 40 durante o horário normal, isso sugere que os compradores ainda estão defendendo a tendência.
Se a fraqueza observada após o expediente persistir na próxima sessão e o preço permanecer abaixo de médias móveis-chave, o sentimento do mercado pode continuar frágil até que surjam novas informações.
Perguntas Frequentes (FAQ)
Por que a ação da MRNA caiu após o expediente hoje?
Após o expediente, a ação da MRNA caiu após o anúncio da Moderna de que a FDA emitiu uma carta de recusa de arquivamento para o BLA da vacina contra influenza mRNA-1010, indicando que a FDA não iniciará a revisão.
A FDA disse que a vacina contra a gripe da Moderna é insegura?
Não. A declaração da Moderna indica que a carta de recusa de arquivamento não identificou preocupações específicas de segurança sobre o mRNA-1010.
Por que a FDA se concentrou na vacina comparadora?
Porque o comparador é a referência para avaliar o desempenho, e a FDA disse que o comparador usado não refletia o "melhor padrão de cuidado disponível", especialmente para adultos mais velhos.
A Moderna espera que isso altere sua orientação para 2026?
A Moderna disse que não espera nenhum impacto em sua orientação financeira para 2026 em decorrência da decisão de recusa de arquivamento. Ainda assim, investidores venderam a ação porque o cronograma do programa contra a gripe nos EUA é importante para a visibilidade de receita no longo prazo.
A Moderna ainda pode obter aprovação fora dos Estados Unidos?
Sim. A Moderna anunciou que a vacina foi aceita para revisão na UE, Canadá e Austrália, com possíveis aprovações esperadas para começar no final de 2026 ou início de 2027.
Conclusão
Em conclusão, a ação da MRNA está em queda após o expediente porque a FDA emitiu uma carta de recusa de arquivamento para o pedido de aprovação da vacina contra influenza mRNA da Moderna, o que aumenta a incerteza de curto prazo em relação ao cronograma nos EUA.
O ponto-chave é que esse movimento diz respeito ao processo regulatório e aos padrões de desenho do estudo, não a um problema de segurança recém-divulgado.
O próximo fator decisivo não é um debate sobre imunologia da influenza. O próximo fator decisivo é se a Moderna conseguirá um caminho claro por meio de uma reunião Tipo A com a FDA e se esse caminho exigirá novos trabalhos clínicos. Até que essa clareza chegue, a ação da MRNA provavelmente negociará como um nome sensível a manchetes e de alta volatilidade até sua próxima janela de resultados.
Aviso legal: Este material é apenas para fins informativos gerais e não tem a intenção de ser (e não deve ser considerado como) aconselhamento financeiro, de investimento ou outro em que se deva confiar. Nenhuma opinião apresentada neste material constitui uma recomendação da EBC ou do autor de que qualquer investimento, título, transação ou estratégia de investimento seja adequado para qualquer pessoa específica.





























