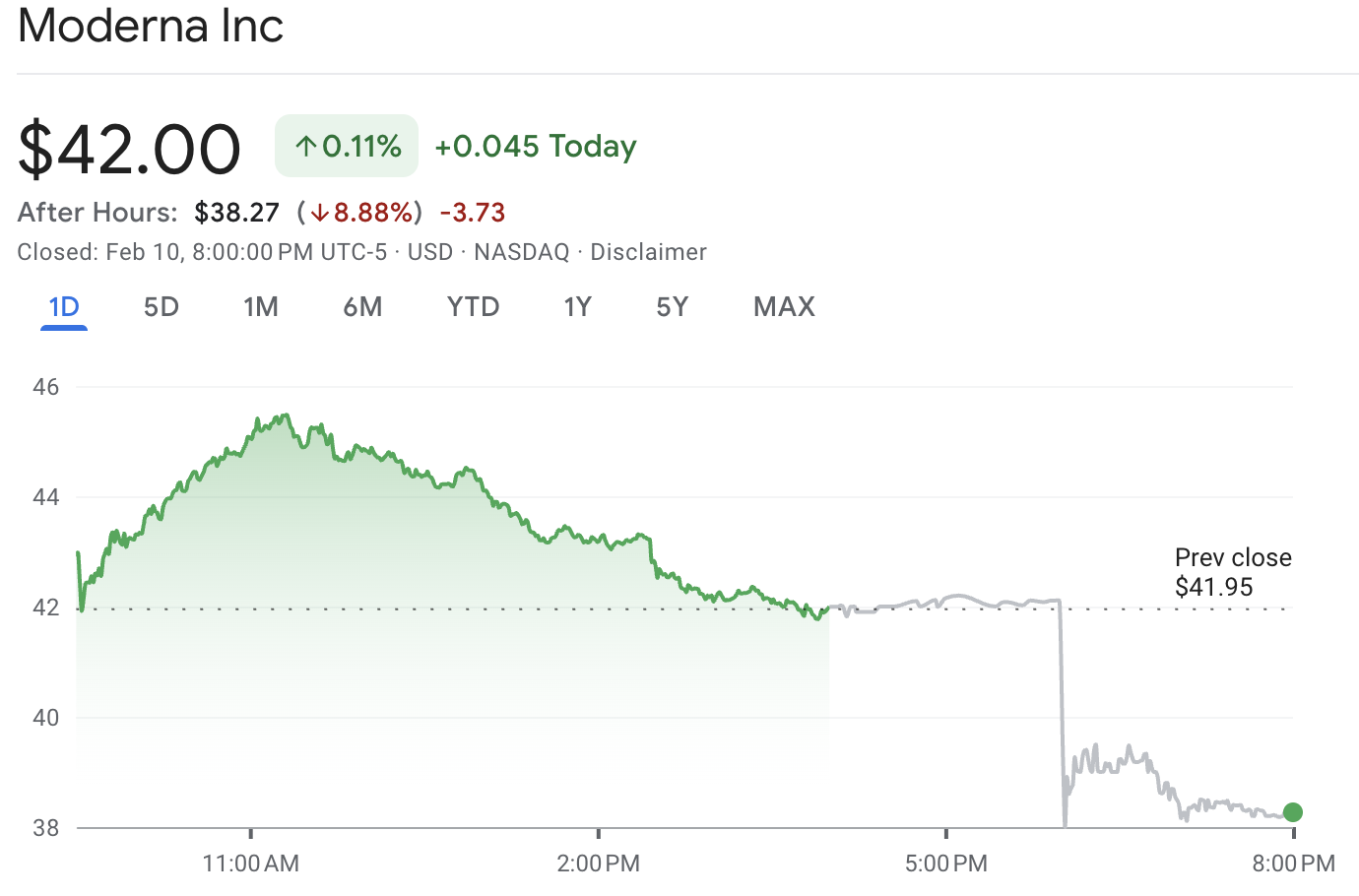
Las acciones de Moderna cotizan a la baja fuera de horario porque la FDA impuso un alto definitivo a un programa que los inversores habían considerado uno de los puentes más realistas hacia el "próximo producto" de Moderna, más allá de su franquicia COVID.
El Centro para la Evaluación y la Investigación de Biológicos (CBER) de la agencia emitió una carta de denegación de admisión a trámite (Refusal-to-File, RTF) para la solicitud de licencia de biológicos (BLA) de Moderna por su vacuna estacional contra la influenza en investigación, mRNA-1010. También indicó que no iniciaría una revisión.

A pesar de ello, Moderna afirma que la carta no planteó preocupaciones de seguridad o eficacia sobre la vacuna en sí, y que el problema está vinculado al comparador del ensayo utilizado en su estudio de eficacia de Fase 3.
Para los inversores, eso basta para mover la acción con rapidez. Cuando el calendario clave de un producto se vuelve menos claro, los mercados tienden a recalibrar el riesgo rápidamente, especialmente en la negociación extendida, cuando la liquidez es menor.
¿Qué le pasó a las acciones de Moderna fuera de horario?
| Elemento |
Nivel / Detalle |
| Cierre de la sesión regular |
~$42.00 |
| Cotización fuera de horario (ejemplo) |
~$38.27 (-8.88%) |
| Rango del día |
~$41.68 a ~$45.50 |
| Rango de 52 semanas |
~$22.28 a ~$55.20 |
Las acciones de Moderna cerró aproximadamente en $42.00 antes de caer hasta cerca de $38.27 en la negociación fuera de horario, lo que representó una caída de alrededor del 8.9% al momento del informe.
¿Cuál fue el principal catalizador?

La FDA se negó a tramitar la solicitud de la vacuna antigripal de Moderna
Moderna comunicó que recibió una carta del Centro para la Evaluación y la Investigación de Biológicos (CBER) de la FDA, en la que se señala que no iniciará la revisión de la solicitud de licencia de biológicos (BLA) para mRNA-1010 y, en su lugar, emitirá una carta de denegación de admisión a trámite (Refusal-to-File, RTF).
La compañía destacó que había utilizado un Priority Review Voucher para ayudar a asegurar una revisión oportuna. Este rechazo es particularmente decepcionante para Moderna desde la perspectiva del mercado, ya que sugiere que el problema no es simplemente estar "en la cola".
Además, Moderna indicó que esta negativa contradice las observaciones recibidas durante las consultas previas a la Fase 3 y previas a la presentación. En consecuencia, la compañía ha solicitado una reunión de Tipo A para clarificar el camino a seguir.
¿Qué es una carta de denegación de admisión a trámite?
Un RTF es una herramienta formal que la FDA utiliza para evitar dedicar tiempo a la revisión de solicitudes que considera incompletas o no aptas para una revisión sustantiva en la etapa de presentación.
El procedimiento interno de la FDA define el RTF como un método para prevenir la revisión innecesaria de solicitudes incompletas. Señala que una acción de RTF permite a los solicitantes subsanar "insuficiencias críticas" antes de presentar una solicitud completa, que luego podrá someterse a una revisión sustantiva.
Dos puntos prácticos son importantes para los inversores:
Un RTF no equivale a una aprobación completa ni a un rechazo tras una revisión completa.
El camino a seguir depende de los cambios solicitados por la FDA y de la capacidad de la compañía para responder con rapidez.
¿Por qué la FDA dijo no a la vacuna contra la gripe de Moderna?

El problema central, según varios informes, es que la FDA no consideró que el diseño del estudio de Moderna fuera "adecuado y bien controlado" porque el brazo comparador no reflejaba la visión de la FDA sobre el mejor estándar de atención disponible, particularmente para las personas mayores.
Según los informes, Moderna comparó mRNA-1010 con una vacuna contra la gripe autorizada de dosis estándar (a menudo citada en la cobertura como Fluarix de GSK).
Al mismo tiempo, la FDA indicó que esperaba un comparador que coincidiera mejor con la forma en que las poblaciones de alto riesgo, especialmente las personas de 65 años o más, suelen vacunarse en Estados Unidos (a menudo con opciones mejoradas o de alta dosis).
Moderna disputa la medida. En su comunicado, la compañía afirmó que el RTF no citó problemas de seguridad o eficacia y describió la decisión como inconsistente con la retroalimentación previa de la FDA.
Afirmaciones clave de Moderna (según su comunicado)
La FDA citó al comparador de dosis estándar como la única razón para negarse a iniciar la revisión.
Moderna declaró que la FDA no identificó preocupaciones específicas de seguridad o eficacia.
Moderna solicitó una reunión de tipo A con la dirección de la FDA para clarificar el camino a seguir.
Moderna indicó que no espera que esta decisión afecte su orientación financiera para 2026.
¿Por qué es tan importante el problema del comparador?
En los ensayos de vacunas, el comparador es el producto "base" que se usa para juzgar el desempeño del nuevo producto. Si el regulador considera que el comparador no representa el estándar real adecuado, puede argumentar que la evidencia no responde a la pregunta que necesita responder.
Por eso los mercados reaccionan con fuerza incluso cuando la compañía dice que no hay una nueva preocupación de seguridad. La disputa cambia el debate de "¿Funciona?" a "¿Cumple la evidencia con el estándar de la FDA para esta población en este momento?"
Esto también explica por qué los traders suelen tratar los titulares de rechazo a iniciar la revisión (RTF) como eventos de calendario. La vacuna aún puede llegar al mercado, pero el calendario se vuelve menos predecible.
Qué significa esto para el calendario de la gripe de Moderna
Moderna anunció que mRNA-1010 se encuentra actualmente en revisión en la UE, Canadá y Australia. La compañía anticipa que las aprobaciones más tempranas en estas regiones ocurrirán a finales de 2026 o principios de 2027, según las evaluaciones actuales.
En Estados Unidos, los siguientes pasos dependerán del resultado de la reunión de tipo A. Esto determinará si Moderna necesita volver a presentar la Solicitud de licencia de productos biológicos (BLA) con datos adicionales, un enfoque diferente o un planteamiento revisado que cumpla con las expectativas de la FDA respecto a los comparadores.
Por qué la reacción de las acciones de Moderna fue tan rápida: reabre una preocupación familiar de Moderna
MRNA ha intentado convencer a los inversores de que su futuro post-COVID se basa en un portafolio, no en un único producto. La gripe es central en esa narrativa porque los mercados respiratorios estacionales son grandes, recurrentes y comercialmente demostrados.
Este rechazo de la FDA obliga a un reajuste en tres frentes.
1) Retrasa una vía de lanzamiento a corto plazo en EE. UU.
Aunque el problema sea solucionable, un RTF significa que Moderna no tiene hoy una revisión activa en la FDA. Eso, por sí solo, reduce la visibilidad a corto plazo y aumenta la brecha entre los "datos" y los "ingresos."
2) Aumenta la incertidumbre en torno a la estrategia combinada respiratoria de Moderna
Moderna retiró su solicitud ante la FDA para la vacuna combinada mRNA-1083 contra la gripe y COVID después de que la FDA solicitara más datos sobre la eficacia frente a la gripe antes de proceder con la revisión. Esa historia importa porque el mercado ya ha visto cómo se retrasó una vez la cronología respiratoria de Moderna.
3) Señala un listón más estricto para los comparadores de vacunas respiratorias
Si la FDA ahora enfatiza comparadores que representen el "mejor estándar de atención disponible" para adultos mayores, eso no es un problema de un solo programa. Puede influir en cómo las compañías diseñan futuros ensayos de influenza y en la rapidez con la que pueden iterar.
Por qué este titular puede influir en la próxima reacción de resultados
La próxima fecha programada de resultados de MRNA es el 13 de febrero de 2026, y el precio de las opciones anticipa un movimiento implícito semanal de aproximadamente 11.63% en esa ventana de evento.
Un movimiento implícito por encima del 10% suele indicar que los inversores esperan una incertidumbre significativa en torno a los titulares, las previsiones o ambos.
Tras un evento de rechazo a iniciar la revisión por parte de la FDA, el mercado suele hacer dos cosas:
Exige un lenguaje más claro sobre el camino a seguir y los plazos.
Revalúa la volatilidad implícita si espera que una comunicación de seguimiento, como el resultado de la reunión con la FDA, caiga cerca de la misma ventana temporal.
Análisis técnico de las acciones Moderna: niveles que los traders deberían vigilar esta noche
| Indicador |
Valor |
Señal |
| RSI (14) |
48.155 |
Neutral |
| MACD (12,26) |
0.29 |
Compra |
| ATR (14) |
0.9374 |
Alta volatilidad |
| ADX (14) |
40.829 |
Venta |
La postura técnica diaria de MRNA era en general neutral, con señales mixtas entre los indicadores y las medias móviles al momento del movimiento después del cierre.
Niveles pivote (clásicos)
| Tipo de nivel |
Nivel de precio |
Cómo suelen usarlo los traders tras un titular |
| Clásico S1 |
$41.74 |
Primera zona donde los compradores en las caídas pueden probar si el mercado se estabiliza. |
| Clásico S2 |
$41.31 |
Una ruptura por debajo aumenta las probabilidades de un nuevo test de soportes más profundos. |
| Clásico S3 |
$40.51 |
Una "línea" clave porque se sitúa cerca de la congestión de medias móviles de más largo plazo. |
| Pivote clásico |
$42.54 |
Recuperar el pivote suele indicar que el mercado está dejando de lado el pánico. |
| Clásico R1 |
$42.97 |
Primer punto de control al alza si la acción rebota hasta las ganancias. |
| Clásico R2 |
$43.77 |
Zona de rebote más fuerte que a menudo requiere aclaración fundamental. |
Cómo leer esta configuración:
Si la acción se mantiene por encima del área baja de los $40 durante el horario normal, sugiere que los compradores siguen defendiendo la tendencia.
Si la debilidad observada después del cierre persiste en la siguiente sesión y el precio se mantiene por debajo de medias móviles clave, el sentimiento del mercado puede seguir siendo frágil hasta que surja nueva información.
Preguntas frecuentes (FAQ)
1. ¿Por qué las acciones de Moderna cae después del cierre hoy?
Después del cierre, las acciones de Moderna cayó tras el anuncio de Moderna de que la FDA emitió una carta de rechazo de presentación (refusal-to-file) para la solicitud BLA de la vacuna contra la gripe mRNA-1010, indicando que la FDA no iniciará una revisión.
2. ¿Dijo la FDA que la vacuna contra la gripe de Moderna es insegura?
No. El comunicado de Moderna indica que la carta de rechazo de presentación (refusal-to-file) no identificó preocupaciones de seguridad específicas sobre mRNA-1010.
3. ¿Por qué la FDA se centró en la vacuna comparadora?
Porque el comparador es el punto de referencia para evaluar el rendimiento, y la FDA dijo que el comparador utilizado no reflejaba el "mejor estándar de atención disponible", particularmente para adultos mayores.
4. ¿Espera Moderna que esto cambie su guía para 2026?
Moderna dijo que no espera ningún impacto en su guía financiera para 2026 a raíz de la decisión de refusal-to-file. Aun así, los inversores vendieron la acción porque el calendario del programa de la gripe en EE. UU. es importante para la visibilidad de ingresos a largo plazo.
5. ¿Puede Moderna aún obtener la aprobación fuera de Estados Unidos?
Sí. Moderna anunció que la vacuna ha sido aceptada para revisión en la UE, Canadá y Australia, con aprobaciones potenciales que se esperan a finales de 2026 o principios de 2027.
Conclusión
En conclusión, las acciones de Moderna cotizan a la baja después del cierre porque la FDA emitió una carta de refusal-to-file para la solicitud de la vacuna antigripal mRNA de Moderna, lo que genera incertidumbre a corto plazo sobre el calendario en EE. UU.
El punto clave es que este movimiento se refiere al proceso regulatorio y a los estándares de diseño del ensayo, no a un problema de seguridad recién divulgado.
El próximo factor decisivo no es un debate sobre la inmunología de la influenza. El próximo factor decisivo es si Moderna puede asegurar un camino claro a través de una reunión Tipo A con la FDA y si ese camino requiere nuevos trabajos clínicos. Hasta que esa claridad llegue, las acciones de Moderna probablemente cotice como un valor sensible a los titulares y de alta volatilidad hasta su próxima ventana de resultados.
Aviso legal: Este material es solo para fines de información general y no pretende ser (y no debe considerarse) asesoramiento financiero, de inversión u otro tipo en el que basar decisiones. Ninguna opinión expresada en el material constituye una recomendación por parte de EBC o del autor de que alguna inversión, valor, operación o estrategia de inversión sea adecuada para una persona en particular.